El gen que puede matarte y también salvarte
No es lo mismo decir “el gato maúlla” que “el pato maúlla”. Solo hemos cambiado una letra (la “p” por la “g”), pero el mensaje cambia por completo y hasta resulta absurdo. Lo mismo ocurre cuando se da un cambio (mutación) en la secuencia de un gen que codifica una proteína importante para nuestro organismo.
Sabemos que el oxígeno es indispensable para vivir. Gracias a este elemento, podemos obtener la energía de los alimentos que permiten el funcionamiento de cada una de nuestras células. Los glóbulos rojos de la sangre son los encargados de llevar el oxígeno a todos los rincones de nuestro cuerpo gracias a una proteína llamada hemoglobina (Hb).

La hemoglobina con sus cuatro componentes. En rojo se representa el grupo “hemo” que transporta el oxígeno. Fuente: Universidad de Miami.
La hemoglobina está formada por cuatro componentes: dos subunidades alfa (α) y dos subunidades beta (β). La subunidad β (HbB) es una larga cadena de 147 aminoácidos representado cada uno por diversas letras (A: alanina, C: cisteína, etc.):
MVHLTPEEKS AVTALWGKVN VDEVGGEALG RLLVVYPWTQ
RFFESFGDLS TPDAVMGNPK VKAHGKKVLG AFSDGLAHLD
NLKGTFATLS ELHCDKLHVD PENFRLLGNV LVCVLAHHFG
KEFTPPVQAA YQKVVAGVAN ALAHKYH
Estas 147 letras (aminoácidos) representan una frase (subunidad β de la Hb o HbB). Si cambiamos la letra E (ácido glutámico) de la séptima posición por una V (valina) provocamos un cambio en la estructura de esta subunidad que se traduce en una hemoglobina defectuosa (HbS). Esta, a su vez, provoca una deformación de los glóbulos rojos que adquieren una forma de hoz (células falciformes), lo que entorpece la circulación sanguínea y causa microinfartos, hemólisis y anemia.
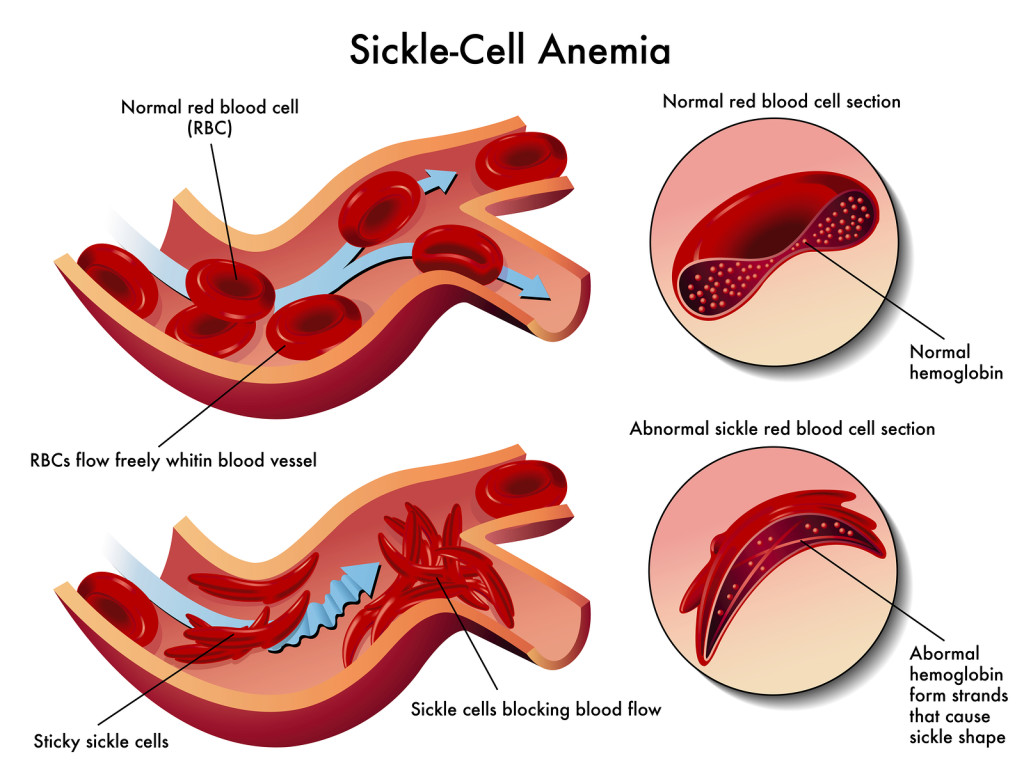
Anemia de células falciformes. Fuente.
Esta mutación es recesiva. Esto quiere decir que si heredas la versión defectuosa (HbS) de uno de tus padres, no padecerás la enfermedad porque la versión sana (HbB) suplirá su función. Los problemas vienen cuando recibes la versión defectuosa de papá y mamá.
Los científicos se han roto la cabeza tratando de entender cómo esta mutación que afecta negativamente a las personas —incluso llevándolas a la muerte— no ha sido depurada por la selección natural. Es más, en las zonas tropicales, el 5% de la población posee la versión HbS, superando el 15% en el África subsahariana. ¿A caso tendrá algo positivo?
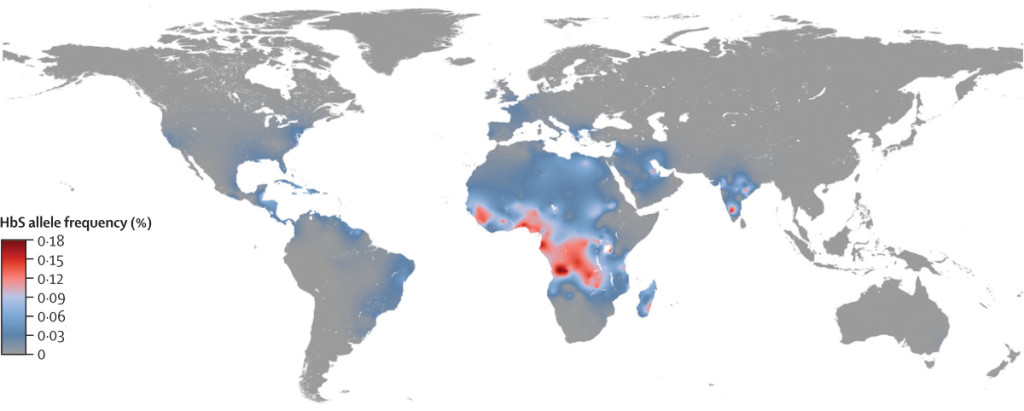
Distribución global del alelo defectuoso del componente de la hemoglobina (HbS). Fuente: The Lancet.
Estudios epidemiológicos han encontrado una fuerte correlación entre la prevalencia del alelo HbS y la incidencia de la malaria. Esta enfermedad, que afecta a más de 200 millones de personas cada año en zonas tropicales, es producida por un parásito llamado Plasmodium falciparum (otros Plasmodium en menor proporción), que son transmitidos por la picadura de un mosquito (Anopheles) y que se alojan y multiplican dentro de los glóbulos rojos. ¿Será que el alelo HbS protege a las personas de la malaria y, por tanto, les da una ventaja selectiva?
Desde hace varias décadas se sospecha que esto es así. Un estudio publicado en el 2005 mostró que poseer el alelo HbS protege en un 50% y 90% los cuadros leves y severos de malaria, respectivamente. Sin embargo, no se sabía cómo esta mutación ejercía su efecto protector.
Cuando el parásito de la malaria invade los glóbulos rojos, empieza a alimentarse de la hemoglobina. Esto provoca la liberación del grupo “hemo” que, gracias a su efecto tóxico, favorece el desarrollo de la enfermedad. Sin embargo, un grupo de investigadores portugueses observó que los ratones que poseían el alelo HbS expresaban una mayor cantidad de la enzima hemo oxigenasa (HO-1), la cual degrada los grupos hemo libres. Al hacerlo produce monóxido de carbono (CO) que se une a la hemoglobina y evita que se liberen más grupos hemo. De esta forma, el desarrollo de la malaria se detiene.
En otras palabras, el alelo HbS ejerce su efecto protector contra la malaria generando un ambiente poco favorable para el desarrollo de la enfermedad.
De esta manera, una mutación que puede provocarte serios problemas de salud (si tienes los dos alelos HbS), puede protegerte de una enfermedad mortal como la malaria (si posees solo un alelo HbS). Es por esta razón que en las zonas con mayor incidencia de esta enfermedad, la proporción de personas que poseen el alelo HbS es mayor pues les da una ventaja selectiva. Aumenta sus probabilidades de supervivencia. Sin embargo, también aumenta las probabilidades de que dos personas portadoras del alelo HbS tengan hijos, los cuales tendrán un 50% de probabilidades de recibir los dos alelos HbS y padecer de anemias, hemólisis y microinfartos.
Hoy en día tenemos una herramienta revolucionaria que permitiría corregir esta mutación y convertir el alelo HbS en HbB. La técnica se llama CRISPR/Cas9. Hace un par de semanas, un grupo de investigadores estadounidenses, demostraron que es posible hacer estas correcciones en el gen de la hemoglobina, al menos en el laboratorio. Sin embargo, aquí viene el dilema. Qué pasaría si un niño que vive en una zona con alta incidencia de malaria nace con los dos alelos HbS. Si no hacemos nada, podría morir a causa de los problemas en sus glóbulos rojos; pero si corregimos el gen defectuoso, lo podríamos volver más susceptible al parásito de la malaria, el cual también podría llevarlo a la muerte. Lo ideal sería corregir solo uno de los alelos HbS, lamentablemente CRISPR/Cas9 no puede hacer eso, por ahora.
Los científicos ya están trabajando en el desarrollo de un CRISPR/Cas9 capaz de editar genes en un sólo alelo. Esto sería un gran avance hacia futuras terapias que permitan no solo tratar enfermedades genéticas, sino también introducir mutaciones en un solo alelo que puedan ser beneficiosas para nosotros.



:quality(75)/2.blogs.elcomercio.pe/service/img/expresiongenetica/autor.jpg)